公司新闻
近日,中国农业大学国家杰出青年科学家团队在国际学术期刊《PNAS》在线发表题为《FcγRⅡB functions as an IgG transporter in the mammary gland》的研究论文。研究通过构建一系列基因修饰动物模型,并结合体外功能验证实验,首次揭示FcγRⅡB是哺乳动物乳腺中负责IgG转运的关键受体。中科奥格生物科技有限公司作为FCGR2B基因(编码FcγRⅡB蛋白)敲除动物模型(猪)的制备单位,参与该项科学研究。
本论文由中国农业大学生物学院赵要风教授、杜旭光教授、张然副教授以及中科奥格创始人潘登科研究员共同担任论文通讯作者。本研究得到中科奥格的研发资助及四川省中央引导地方科技发展专项项目的资助.

哺乳动物刚出生时,自身免疫系统尚未完全建立,会经历一段易受感染的窗口期,这段时期需要依靠母源被动免疫物质抵御病原微生物感染。其中,母源IgG的传递是新生动物获得母源被动免疫的主要表现方式。
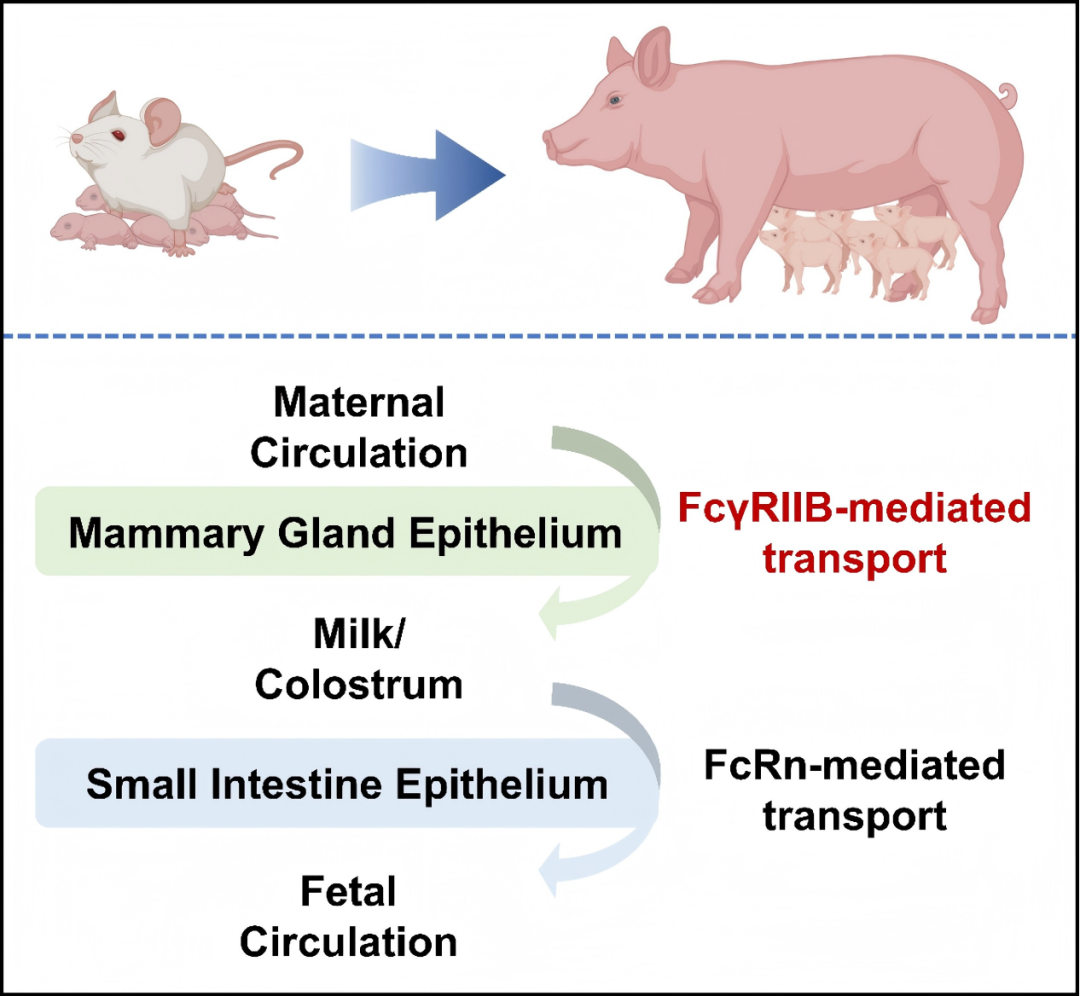
不同物种传递母源IgG的方式不同:第一类以人和兔为代表动物,母源IgG只在出生前穿过胎盘细胞层屏障转运,从母体血液循环直接进入胎儿血液循环;第二类以大型家畜(猪、牛、羊和马)为代表动物,母源IgG先通过乳腺细胞层屏障转运,从母体血液循环到达乳汁,后代吸食乳汁后,再通过小肠细胞层屏障转运,进而被吸收到子代血液循环;第三类以大鼠、小鼠和犬为代表动物,母源IgG可以通过上述两种途径传递。
IgG穿过胎盘(或卵黄囊)细胞层和小肠细胞层屏障均是由新生儿Fc受体(Neonatal Fc receptor,FcRn)介导。然而,IgG如何穿过乳腺细胞层屏障的机制尚不清楚。
为了验证血清IgG跨乳腺细胞层屏障进入初乳是否也通过FcRn介导,中国农业大学赵要风教授团队前期联合中科奥格构建了FCGRT基因(编码FcRn蛋白)敲除猪模型,明确证实FcRn并非猪血清IgG向初乳转移的媒介,研究成果于2020年在《Immunology》上发表。

为了进一步研究IgG是如何跨越乳腺细胞层屏障的,赵要风教授团队联合包括中科奥格在内的多家单位,利用一系列基因修饰动物模型结合体外试验,首次证实:FcγRⅡB能介导IgG的内吞和跨细胞转运;在FcγRⅡB过表达转基因小鼠中,乳汁IgG水平显著提升;单细胞转录组测序显示,FcγRⅡB主要表达的细胞类型为乳腺腔上皮细胞,且表达水平呈分娩前高表达、分娩后急剧下降的动态变化;FCGR2B基因敲除母猪的初乳中IgG含量骤降,仅为野生型母猪的约3%。
本系列研究创新性地建立FCGRT和FCGR2B基因敲除大动物模型,突破传统小鼠模型局限,证实了乳腺FcγRⅡB介导的IgG转运影响后代免疫发育:FcγRⅡB敲除母猪所产仔猪血清IgG长期降低,T细胞比例下降,炎症因子失衡,呈现炎症表型。同时揭示了FcγRⅡB的双重功能:既是已知的免疫抑制受体,也是IgG转运受体,与FcRn协同完成不同物种的母源IgG传递。
结语
我国小型猪具有体型适中、遗传背景清晰、繁殖周期短且饲养成本相对较低等优势,是极具价值的实验大型动物模型。相较于小鼠等小型啮齿类动物,猪在免疫、代谢及心血管等关键生理系统上与人类更为接近;与非人灵长类动物相比,则具有来源更稳定、伦理争议较少的特点。因此,小型猪能够有效填补现有临床前研究模型的种属差异,为提高药物研发的临床转化成功率提供重要支撑。不仅如此,基于小型猪优良的遗传特性与高效的繁育体系,其也在农业领域展现出重要潜力。通过基因编辑技术,可以培育出抗病力强、生长性能优异、肉质改良或环境适应性更强的小型猪品系,从而推动畜牧业的可持续发展。 中科奥格作为国内基因编辑猪领域的头部企业,利用基因编辑和体细胞克隆技术构建动物模型,支撑中国农业大学、西北农林科技大学、四川农业大学等高校科学研究。同时,中科奥格储备了动脉粥样硬化、肝损伤等多种疾病动物模型,助力生命科学领域的研究与创新。